Anvisa aprova vacinas bivalentes para dose de reforço contra Covid-19

Vacinas da Pfizer protegem contra novas variantes do vírus.
A Diretoria Colegiada da Anvisa aprovou, nesta terça-feira (22/11), o uso temporário e emergencial de duas vacinas bivalentes contra Covid-19 da empresa Pfizer (Comirnaty). As vacinas aprovadas são para uso como dose de reforço na população a partir de 12 anos.
As vacinas bivalentes oferecem proteção contra mais de uma cepa de um vírus. As vacinas aprovadas protegem contra:
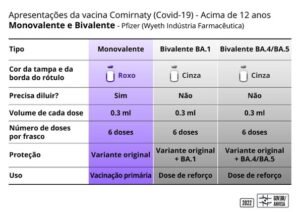
Bivalente BA1 – protege contra a variante original e também contra a variante Ômicron BA1.
Bivalente BA4/BA5 – protege contra a variante original e também contra a variante Ômicron BA4/BA5.
Segundo a diretora relatora, Meiruze Freitas, o objetivo do reforço com a vacina bivalente é expandir a resposta imune específica à variante Ômicron e melhorar a proteção da população. “Entretanto, as pessoas, principalmente os grupos de maior risco, não devem atrasar sua vacinação de dose de reforço já planejada para esperar o acesso à vacina bivalente, pois todas as vacinas de reforço aprovadas ajudam a melhorar a proteção contra casos graves e morte por Covid-19”, afirmou a diretora da Anvisa.
Características das vacinas aprovadas
– Identificadas por tampa na cor cinza. O rótulo trará a seguinte identificação: Comirnaty® Bivalente BA.1 ou Comirnaty® Bivalente BA.4/BA.5.
– Cada frasco possui seis doses e a vacina não deve ser diluída.
– Indicadas para a população a partir de 12 anos de idade.
– Indicadas como reforço. Devem ser aplicadas a partir de três meses após a série primária de vacina ou reforço anterior.
– Validade de 12 meses, quando estocadas de -80°C a -60°C ou de -90°C a -60°C.
– Podem ser armazenadas em geladeira, entre 2°C e 8°C, por um único período de até dez semanas, não excedendo a data de validade original.
Cenário internacional
A vacina Comirnaty Bivalente BA1 está aprovada em 35 países.
A vacina Comirnaty Bivalente BA4/BA5 está aprovada em 33 países, tais como Canadá, Japão, Reino Unido, EUA, Austrália e Singapura, entre outros, além da União Europeia.
Especialistas externos
Para a análise das duas vacinas bivalentes, a Anvisa também contou com um grupo de especialistas externos da Sociedade Brasileira de Pediatria (SBP), da Sociedade Brasileira de Infectologia (SBI), da Sociedade Brasileira de Imunização (SBIm) e da Sociedade Brasileira de Pneumologia e Tisiologia (SBPT), os quais emitiram parecer consultivo para auxiliar o trabalho de análise da Agência.
Vacinas monovalentes
Essas vacinas ainda mantêm a efetividade contra a doença na forma grave e óbitos, desde que as doses sejam aplicadas conforme a recomendação do Ministério da Saúde. Os estudos indicam que as doses de reforço das vacinas monovalentes restauraram uma proteção contra desfechos graves associados à Ômicron. A versão original da vacina monovalente da Pfizer está registrada no Brasil deste 23/2/2021.
Há outros pedidos de autorização para vacinas bivalentes?
Não. Até o momento a Anvisa não recebeu outros pedidos de vacinas contra a Covid-19 que incluam cepas de novas variantes.
Por Márcio Gomes (Redação Jornal Correio da Semana)









